Achtergrond en onderzoeksopzet
Retatrutide (LY3437943) is een nieuw enkelvoudig peptidegeneesmiddel datdrie receptoren tegelijk: GIP, GLP-1 en glucagon. Om de werkzaamheid en veiligheid ervan bij mensen met obesitas maar zonder diabetes te evalueren, werd een fase 2, gerandomiseerde, dubbelblinde, placebogecontroleerde studie uitgevoerd (NCT04881760). In totaal338 deelnemersmet een BMI ≥ 30 of ≥ 27 met ten minste één gewichtsgerelateerde comorbiditeit, werden gerandomiseerd om placebo of retatrutide (1 mg, 4 mg met twee titratieschema's, 8 mg met twee titratieschema's of 12 mg) te ontvangen, eenmaal per week toegediend via subcutane injectie gedurende 48 weken.primair eindpuntwas de procentuele verandering in lichaamsgewicht na 24 weken, met secundaire eindpunten waaronder gewichtsverandering na 48 weken en categorische drempelwaarden voor gewichtsverlies (≥5%, ≥10%, ≥15%).
Belangrijkste resultaten
-
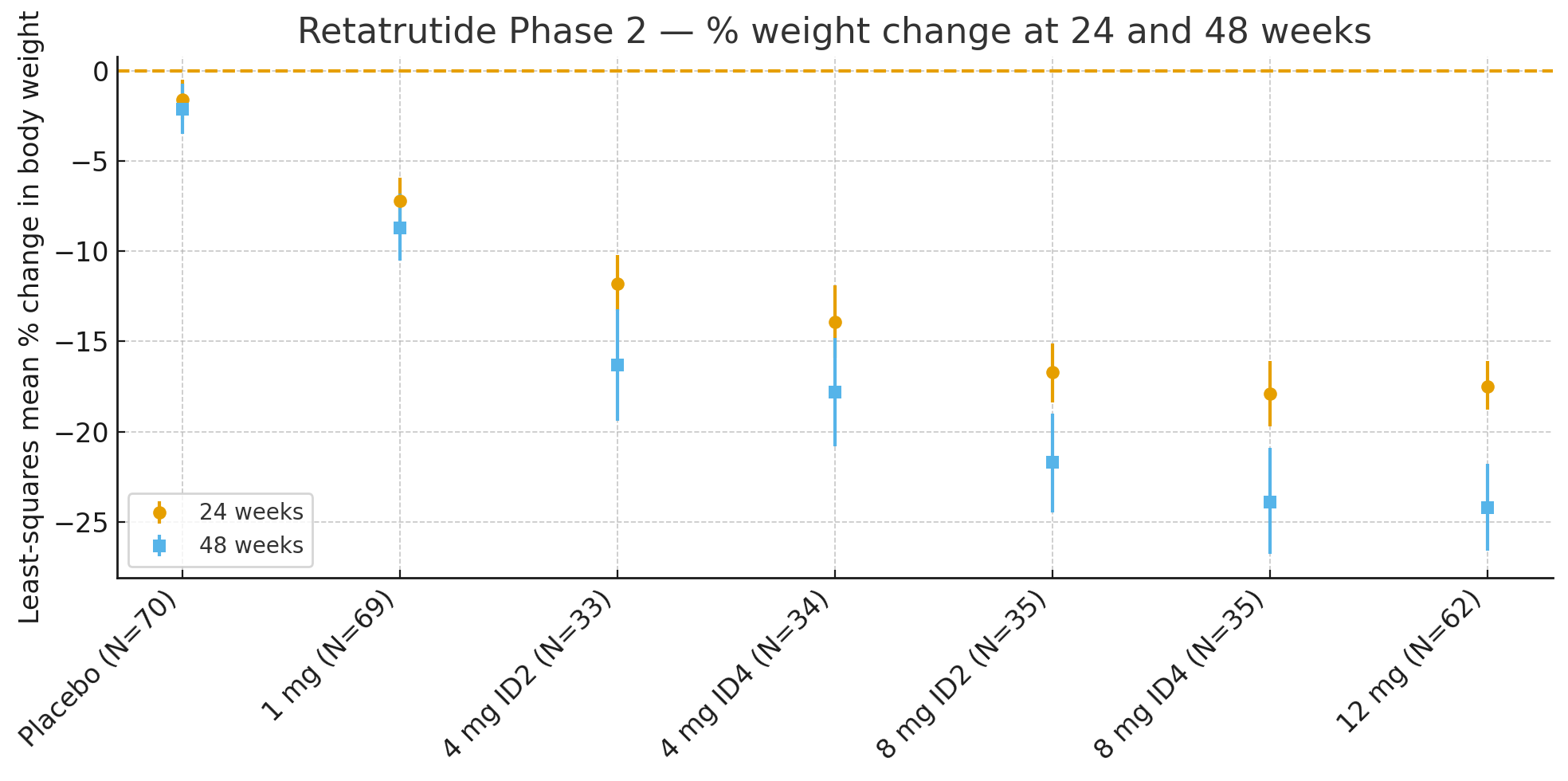
24 weken: Het kleinste-kwadraten gemiddelde percentage verandering in lichaamsgewicht ten opzichte van de uitgangswaarde was
-
Placebo: -1,6%
-
1 mg: -7,2%
-
4 mg (gecombineerd): -12,9%
-
8 mg (gecombineerd): -17,3%
-
12 mg: -17,5%
-
-
48 weken: Het percentage verandering in lichaamsgewicht was
-
Placebo: -2,1%
-
1 mg: -8,7%
-
4 mg (gecombineerd): -17,1%
-
8 mg (gecombineerd): -22,8%
-
12 mg: -24,2%
-
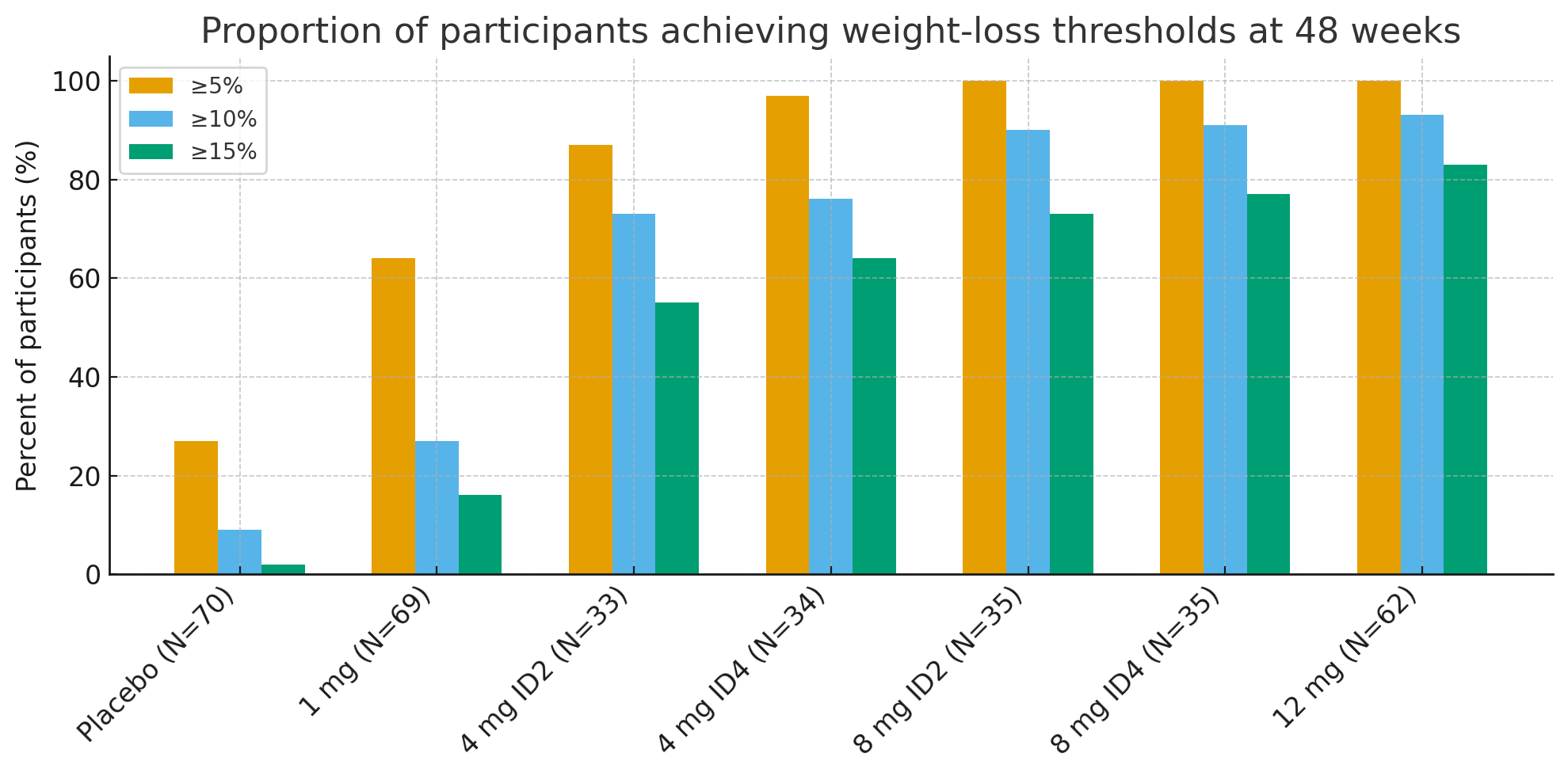
Na 48 weken waren de percentages deelnemers die klinisch relevante gewichtsverliesdrempels bereikten opvallend:
-
≥5% gewichtsverlies: 27% met placebo versus 92–100% in actieve groepen
-
≥10%: 9% met placebo versus 73–93% in actieve groepen
-
≥15%: 2% met placebo versus 55–83% in actieve groepen
In de 12 mg-groep tot26% van de deelnemers verloor ≥30% van hun uitgangsgewicht, een omvangrijk gewichtsverlies vergelijkbaar met bariatrische chirurgie.
Veiligheid
De meest voorkomende bijwerkingen waren gastro-intestinaal (misselijkheid, braken, diarree), over het algemeen mild tot matig en dosisgerelateerd. Lagere startdoses (titratie van 2 mg) verminderden deze bijwerkingen. Er werden dosisgerelateerde hartslagverhogingen waargenomen, met een piek in week 24, die vervolgens weer afnamen. Het percentage patiënten dat stopte met de behandeling varieerde van 6 tot 16% in de actieve groepen, iets hoger dan placebo.
Conclusies
Bij volwassenen met obesitas zonder diabetes werd gedurende 48 weken wekelijks subcutaan retatrutide toegediendaanzienlijke, dosisafhankelijke verminderingen van het lichaamsgewicht(tot ~24% gemiddeld verlies bij de hoogste dosis), samen met verbeteringen in cardiometabole markers. Gastro-intestinale bijwerkingen kwamen vaak voor, maar waren beheersbaar met titratie. Deze bevindingen uit fase 2 suggereren dat retatrutide een nieuwe therapeutische benchmark voor obesitas zou kunnen vormen, in afwachting van bevestiging in grotere, langetermijnfase 3-onderzoeken.
Plaatsingstijd: 28-09-2025